登録販売者 第4章:法規
第2節:医薬品の分類・取扱い等
第3項:医薬部外品、化粧品、保健機能食品等 全記述
3)医薬部外品、化粧品、保健機能食品等
【医薬部外品】
「医薬部外品は、法において次のように定義されている。」
「一 次のイからハまでに掲げる目的のために使用される物であつて機械器具等でないもの」
「イ 吐きけその他の不快感又は口臭若しくは体臭の防止」
「ロ あせも、ただれ等の防止」
「ハ 脱毛の防止、育毛又は除毛」
「二 人又は動物の保健のためにするねずみ、はえ、蚊、のみその他これらに類する生物の防除の目的のために使用される物であつて機械器具等でないもの」
「三 人の疾病の診断、治療若しくは予防に使用されること、又は人の身体の構造若しくは機能に影響を及ぼすことを目的のために使用される物(前二号に掲げる物を除く。)のうち、厚生労働大臣が指定するもの」
「医薬部外品は、その効能効果があらかじめ定められた範囲内であって、成分や用法等に照らして人体に対する作用が緩和であることを要件として、医薬品的な効能効果を表示・標榜することが認められている(※1)。」
「また、化粧品としての使用目的(※2)を有する製品について、医薬品的な効能効果を表示・標榜しようとする場合には、その効能効果があらかじめ定められた範囲内であって、」
「人体に対する作用が緩和であるものに限り、医薬部外品の枠内で、薬用化粧品類、薬用石けん、薬用歯みがき類等として承認されている。」
「医薬部外品を製造販売する場合には、製造販売業の許可が必要であり、厚生労働大臣が基準を定めて指定するものを除き、品目ごとに承認を得る必要がある。」
「一方、販売等については、医薬品のような販売業の許可は必要なく、一般小売店において販売等することができる。」
「また、医薬部外品の直接の容器又は直接の被包には、「医薬部外品」の文字の表示その他定められた事項の表示が義務付けられている。」
「医薬部外品のうち、」
「(1)衛生害虫類(ねずみ、はえ、蚊、のみその他これらに類する生物)の防除のため使用される製品群(「防除用医薬部外品」の表示のある製品群)、」
「(2)かつては医薬品であったが医薬部外品へ移行された製品群(「指定医薬部外品」の表示のある製品群)については、」
「用法用量や使用上の注意を守って適正に使用することが他の医薬部外品と比べてより重要であるため、一般の生活者が購入時に容易に判別することができ、また、実際に製品を使用する際に必要な注意が促されるよう、各製品の容器や包装等に識別表示がなされている。」
「医薬部外品にあっても、医薬品と同様に、不良医薬部外品及び不正表示医薬部外品の販売は禁止されている。」
【化粧品】
「化粧品は、法第2条第3項において次のように定義されている。」
「人の身体を清潔にし、美化し、魅力を増し、容貌を変え、又は皮膚若しくは毛髪を健やかに保つために、身体に塗擦、散布その他これらに類似する方法で使用されることが目的とされている物で、」
「人体に対する作用が緩和なもの」
「人の疾病の診断、治療若しくは予防に使用されること、又は人の身体の構造若しくは機能に影響を及ぼすことを目的とするものは化粧品に含まれない。」
「化粧品は、あくまで「人の身体を清潔にし、美化し、魅力を増し、容貌を変え、又は皮膚若しくは毛髪を健やかに保つ」の範囲内においてのみ効能効果を表示・標榜することが認められるものであり、医薬品的な効能効果を表示・標榜することは一切認められていない。」
「一方、医薬品について化粧品的な効能効果を表示・標榜することは、過度の消費や乱用等の不適正な使用を助長するおそれがあり、承認された効能効果に含まれる場合を除き、適当でないとされている。」
「なお、医薬部外品に、化粧品的効能効果を標榜することは、前項で記したように薬用化粧品、薬用石けん、薬用はみがき等が認められている。」
「化粧品の成分本質(原材料)についても、原則として医薬品の成分を配合してはならないこととされており、配合が認められる場合にあっても、添加物として使用されているなど、薬理作用が期待できない量以下に制限されている。」
「化粧品を業として製造販売する場合には、製造販売業の許可を受けた者が、あらかじめ品目ごとの届出を行う必要がある。」
「ただし、厚生労働大臣が指定する成分を含有する化粧品である場合は、品目ごとの承認を得る必要がある。」
「また、化粧品を販売等する場合には、医薬品のような販売業の許可は必要なく、一般小売店において販売等することができる。」
「ただし、医薬品的な効能効果の表示・標榜がなされた場合には、法により禁止される虚偽又は誇大な広告に該当するほか、その標榜内容等によっては医薬品又は医薬部外品とみなされ、無承認無許可医薬品又は無承認無許可医薬部外品として法に基づく取締りの対象となる。」
「化粧品にあっても、医薬品と同様に、不良化粧品及び不正表示化粧品の販売は禁止されている。」
【保健機能食品等の食品】
「食品とは、医薬品、医薬部外品及び再生医療等製品以外のすべての飲食物をいう(食品安全基本法第2条、食品衛生法)。」
「医薬品には、その品質、有効性及び安全性の確保のために必要な規制が行われているが、食品には、専ら安全性の確保のために必要な規制その他の措置が図られている。」
「外形上、食品として販売等されている製品であっても、その成分本質、効能効果の標榜内容等に照らして医薬品とみなされる場合には、法に基づく承認を受けずに製造販売され、又は法の規定に基づく製造業の許可等を受けずに製造された医薬品(無承認無許可医薬品)として、法に基づく取締りの対象となる。」
「その本質、形状、表示された効能効果、用法用量等から判断して医薬品である物が、外形上、食品として販売等されている場合には、」
「(1) 一般の生活者に正しい医療を受ける機会を失わせ、疾病を悪化させるなど、保健衛生上の危害を生じさせる、」
「(2) 不良品及び偽医薬品が製造販売される、」
「(3) 一般の生活者における医薬品及び食品に対する概念を崩壊させ、医薬品の正しい使用が損なわれ、ひいては医薬品に対する不信感を生じさせる、等の弊害をもたらすおそれがある。」
「しかし、経口的に摂取される物が法に規定する医薬品に該当するか否かについては、一般の生活者から見て必ずしも明確でない場合があるため、無承認無許可医薬品の指導取締りの一環として「医薬品の範囲に関する基準が示されている。」
「この通知で示す「医薬品の範囲に関する基準」では、医薬品に該当する要素として、」
「(a) 成分本質(原材料)が、専ら医薬品として使用される成分本質を含むこと(※3)(食品添加物と認められる場合を除く。)」
「(b) 医薬品的な効能効果が標榜又は暗示されていること(製品表示や添付文書によるほか、チラシ、パンフレット、刊行物、インターネット等の広告宣伝物等による場合も含む。)」
「(c) アンプル剤や舌下錠、口腔用スプレー剤等、医薬品的な形状(※4)であること」
「(d) 服用時期、服用間隔、服用量等の医薬品的な用法用量の記載があること(調理のために使用方法、使用量等を定めている場合を除く。)」
「…が示されており、食品の販売を行う者(薬局又は医薬品の販売業において食品を販売する場合を含む。)にあっては、これらに照らして医薬品に該当する物とみなされることのないよう留意する必要がある。」
「食品のうち、健康増進法の規定に基づく許可又は同法の規定に基づく承認を受けた内容を表示する特別用途食品(特定保健用食品を含む。)については、原則として、一般の生活者が医薬品としての目的を有するものであるとの誤った認識を生じるおそれはないものとされている。」
「ただし、特別用途食品(特定保健用食品を含む。)以外の食品において、特定の保健の用途に適する旨の効果が表示・標榜されている場合には、医薬品の効能効果を暗示させるものとみなされる。」
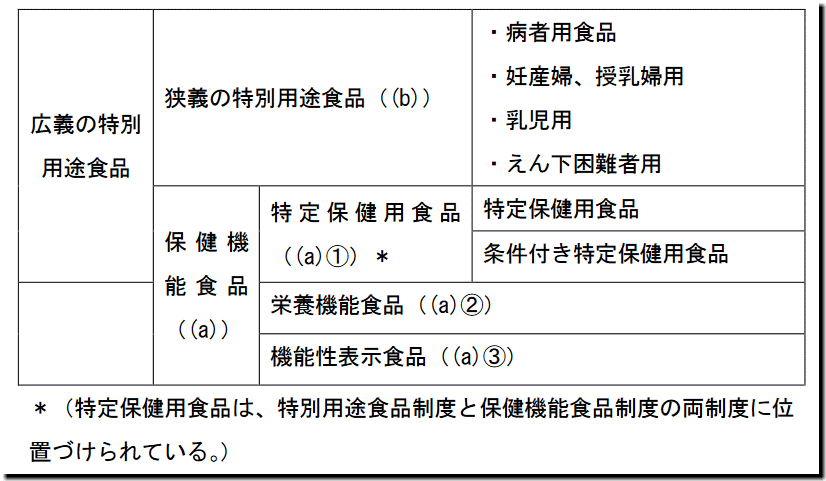
(a) 保健機能食品
「① 特定保健用食品、② 栄養機能食品、③ 機能性表示食品を総称して「保健機能食品」という。」
「これらはあくまで食生活を通じた健康の保持増進を目的として摂取されるものである。」
「なお、① ~ ③及び(b) 特別用途食品(特定保健用食品を除く。)のいずれであっても、食品として販売に供するものについて、健康の保持増進効果等につき虚偽又は誇大な表示をすることは禁止されている。」
「① 特定保健用食品」
「健康増進法の規定に基づく承認を受けて、食生活において特定の保健の目的で摂取をする者に対し、その摂取により当該保健の目的が期待できる旨の表示をする食品である。」
「特定の保健の用途を表示するには、個別に生理的機能や特定の保健機能を示す有効性や安全性等に関する審査を受け、許可又は承認を取得することが必要である。」
「現行の特定保健用食品の許可の際に必要とされる有効性の科学的根拠のレベルに達しないものの、一定の有効性が確認されるものについては、限定的な科学的根拠である旨の表示をすることを条件として許可されている。この条件で許可された特定保健用食品を「条件付き特定保健用食品」と区分している。」
「特定保健用食品及び条件付き特定保健用食品にも、それぞれ消費者庁の許可等のマークが付されている。」
「② 栄養機能食品」
「1日当たりの摂取目安量に含まれる栄養成分の量が、基準に適合しており、栄養表示しようとする場合には、食品表示基準の規定に基づき、その栄養成分の機能の表示を行わなければならない。」
「栄養成分の機能表示に関しては、消費者庁長官の許可は要さないが、その表示と併せて、当該栄養成分を摂取する上での注意事項を適正に表示することが求められている。」
「また、消費者庁長官の個別の審査を受けたものではない旨の表示も義務づけられている。」
「③ 機能性表示食品」
「食品表示法の規定に基づく食品表示基準に規定されている食品である。」
「事業者の責任において、科学的根拠に基づいた機能性を表示し、販売前に安全性及び機能性の根拠に関する情報などが消費者庁長官へ届け出られたものである。」
「特定の保健の目的が期待できる(健康の維持及び増進に役立つ)という食品の機能性を表示することはできるが、特定保健用食品とは異なり、消費者庁長官の個別の許可を受けたものではない。」
(b) 特別用途食品(特定保健用食品を除く。)
「乳児、幼児、妊産婦又は病者の発育又は健康の保持若しくは回復の用に供することが適当な旨を医学的・栄養学的表現で記載し、かつ、用途を限定したもので、」
「健康増進法の規定に基づく許可又は同法の規定に基づく承認を受け、「特別の用途に適する旨の表示」をする食品であり、消費者庁の許可等のマークが付されている。」
「(a)①特定保健用食品の標識」と「(a)①条件付き特定保健用食品の標識」
(b)特別用途食品の標識
「以上に述べた(a) 保健機能食品、(a)① 特定保健用食品、(a)② 栄養機能食品、(a)③機能性表示食品、(b)特別用途食品(特定保健用食品を除く。)の規制上の関係を図示すると次表のとおりとなる。」
「また、食品のうち、食品表示法の規定に基づき制定された食品表示基準の規定に基づき栄養成分の機能表示等がなされたもの((a)②栄養機能食品)における当該表示等に関しては、医薬品の範囲に関する基準における医薬品的な効能効果に該当しないものとされている(※5)。」
「なお、機能性表示食品については、令和6年3月に発生した紅麹関連製品による健康被害を受けて、」
「① 事業者の責任において機能性関与成分によって健康維持・増進に資する特定の保健目的が期待できる旨を表示し、反復・継続して摂取されることが見込まれる機能性表示食品について、」
「事業者(届出者)は、健康被害と疑われる情報を収集し、健康被害と疑われる情報(医師が診断したものに限る。)を把握した場合は、当該食品との因果関係が不明であっても速やかに消費者庁長官及び都道府県知事等(都道府県知事、保健所を設置する市の市長又は特別区の区長)に情報提供することを、食品表示法に基づく内閣府令である食品表示基準における届出者の遵守事項とする」
「② 製造工程管理による製品の品質の確保を徹底する観点から、機能性表示を行う天然抽出物等を原材料とする錠剤、カプセル剤等食品については」
「 GMP に基づく製造管理を食品表示法に基づく内閣府令である食品表示基準における届出者の遵守事項とするなどの食品表示基準の改正が令和6年8月に行われ、同年9月より施行されている。(※6)(※7)」
「特定保健用食品についても、「特定保健用食品の表示許可等について」(次長通知)において許可等に係る食品の健康被害(医師の診断を受け、当該症状が当該食品に起因する又はその疑いがあると診断されたものに限る。)に関する情報を収集し、」
「その発生及び拡大のおそれがある旨の情報を得た場合には、当該情報を都道府県知事等に速やかに提供するとともに、当該情報について消費者庁長官に提供する体制が整っていることを許可等の要件とした。」
(c) その他「いわゆる健康食品」
「健康食品という単語は、法令で定義された用語ではないが、一般に用いられている単語である。」
「栄養補助食品、サプリメント、ダイエット食品等と呼ばれることもある。法や食品衛生法等における取扱いは、保健機能食品以外の一般食品と変わるところはない。」
「いわゆる健康食品の中には、特定の保健の用途に適する旨の効果等が表示・標榜されている場合(※8)があり、それらについては、医薬品の効能効果を暗示するものとみなされる。」
「また、製品中に医薬品成分が検出される場合もあり、いずれも無承認無許可医薬品として、法に基づく取締りの対象となる。」
「これまでにそうした無承認無許可医薬品の摂取によって重篤な健康被害が発生した事例も知られており、厚生労働省、消費者庁や都道府県等では、因果関係が完全に解明されていなくとも、広く一般に対して注意を喚起して健康被害の拡大防止を図るため、製品名等を公表している。」
「薬局、店舗販売業又は配置販売業に従事する専門家においては、行政庁が公表する無承認無許可医薬品情報、健康被害情報に日頃から留意しておくことも重要である。」
注記‐※1
「医薬品と同様、販売元の企業等においては、製品を上市するにあたってあらかじめ医薬部外品として品質、有効性及び安全性が備わっていることにつき、法の規定に基づく承認を取得し(厚生労働大臣が基準を定めて指定する医薬部外品を除く。)、また、製造販売業の許可を受ける必要がある。」
「必要な承認を受けていない製品の販売等は禁止されており、本規定に違反して販売等を行った者については、「3年以下の懲役若しくは300万円以下の罰金に処し、又はこれを併科する」こととなっている。」
注記‐※2
「法第2条第3項に規定する使用目的。」
注記‐※3
「製品から実際に検出されなくても、含有又は配合されている旨が標榜・表示されている場合には、当該成分本質を含むものとみなして本基準が適用される。」
注記‐※4
「錠剤、丸剤、カプセル剤、顆粒剤、散剤等の形状については、食品である旨が明示されている場合に限り、当該形状のみをもって医薬品への該当性の判断がなされることはない。」
注記‐※5
「ただし、規格基準が定められている栄養成分以外の他の成分について、その機能の表示又は特定の保健の用途の表示がなされている場合には、医薬品の範囲に関する基準の(2)医薬品的な効能効果に該当するものとみなされることがある。」
注記‐※6
「①の健康被害情報の収集及び医師の診断による健康被害情報の保健所等への提供については即日実施としているが、②の機能性表示を行う天然抽出物等を原材料とする錠剤、カプセル剤等食品の届出に関する製造加工等における GMP 基準の適用については令和8年9月1日までの経過措置期間が設けられている。」
注記‐※7
「このほか、食品衛生法施行規則についても、令和6年8月の改正により、健康被害と疑われる情報(医師が診断したもの に限る。)を把握した特定保健用食品に係る許可を受けた者及び機能性表示食品の届出者に対して、都道府県知事等(都道 府県知事、保健所を設置する市の市長又は特別区の区長)への情報提供が義務づけられた。」
注記‐※8
「容易に測定可能な体調の指標の維持に適する又は改善に役立つ旨の表現(例:肥満改善効果 等)や、身体の生理機能、組織機能の良好な維持に適する又は改善に役立つ旨の表現(例:老廃物排出効果 等)、身体の状態を本人が自覚でき、一時的であって継続的・慢性的でない体調の変化の改善に役立つ旨(例:二日酔い改善効果 等)などの表現が該当する。」
ページリンク
「医薬部外品、化粧品、保健機能食品等」の全記述は、以上です。
補足リンク
大元インデックス・・・「Webテキスト インデックス」
本章インデックス・・・「法規 インデックス」
本節インデックス・・・「医薬品の分類・取扱い等 インデックス」
こまごましたもの
登録販売者の独学方法については、「登録販売者の独学」を、参考にしてください。
登録販売者のブログ記事などは、「サイトマップ」に、挙げています。
★みんなとシェアする
3)保健機能食品等
医薬部外品
化粧品
保健機能食品等の食品
├保健機能食品等 その2
├(a)保健機能食品
├特定保健用食品
├栄養機能食品
├機能性表示食品
├(b)特別用途食品
├まとめ的な記述・表・マーク
├紅麹関連製品による健康被害
└その他「いわゆる健康食品」
通読用
サイト内リンク
登録販売者
概要
独学シリーズ
対策シリーズ
勉強方法
過去問+解説
├チェック問題 過去問リスト
├漢方 過去問リスト
├生薬 過去問リスト
├全ブロック 試験問題 科目別
├「医薬品的な問題」過去問リスト
├「添付文書」過去問リスト
└「資料問題」過去問リスト