登録販売者 第5章:適正使用
第2節:医薬品の安全対策
第1項:医薬品の副作用情報等の収集、評価及び措置
1 医薬品の副作用情報等の収集、評価及び措置 その2
【企業からの副作用等の報告制度】
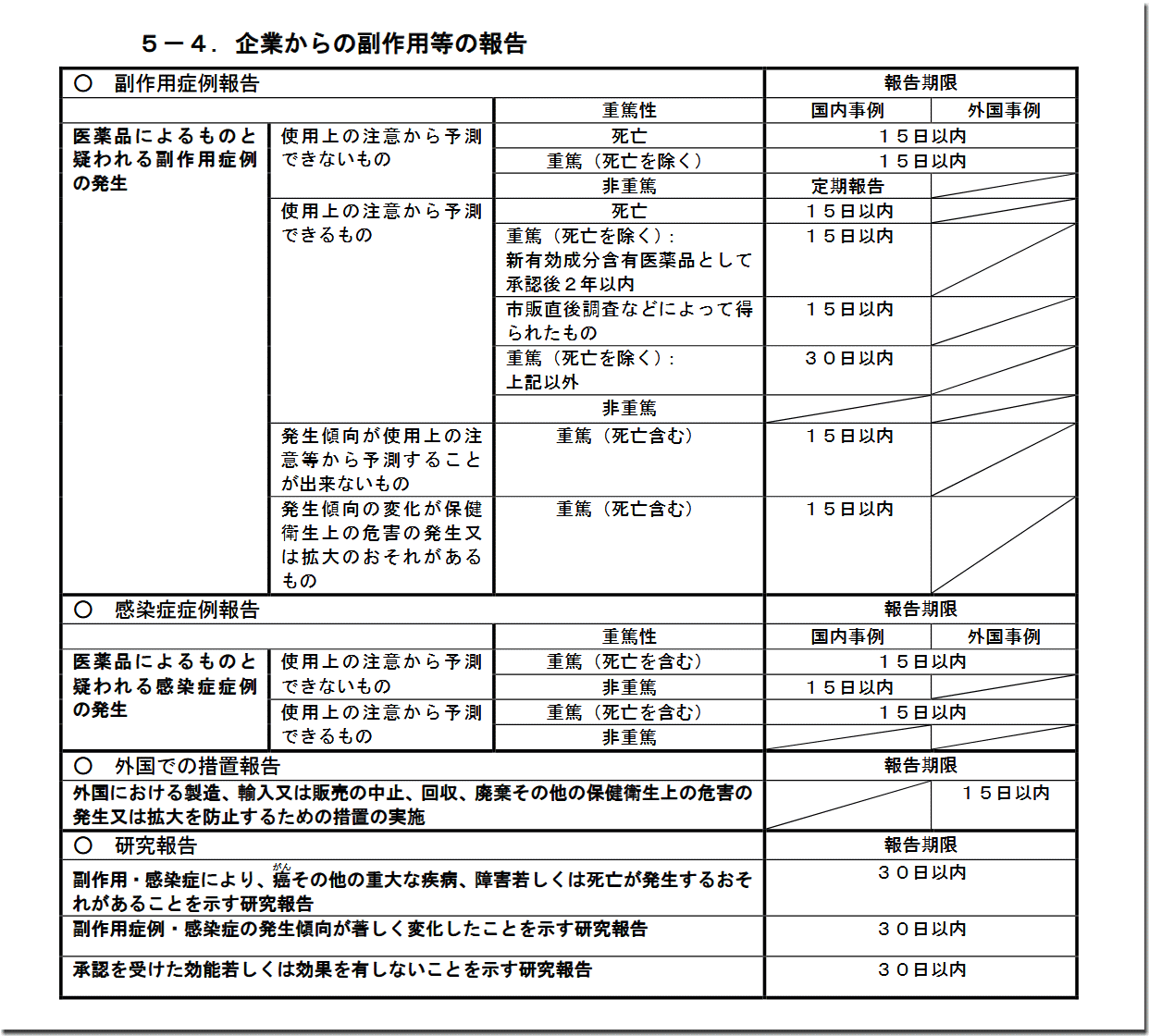
ひとくちコメント
当該企業からの副作用等の報告制度ですが、手引きの記述だけでなく、上の画像に出てくる各数字を憶えなくてはいけません。
近年では、定番論点と化しています。当サイトの「企業からの副作用等の報告 過去問」などで、試験問題をチェックしておきましょう。
ただ、毎回出るわけではないので、費用対効果がちょっぴり悪いです。
よって、試験勉強の後半あたりから、ボチボチと手を付けるといいでしょう。
「適正使用の「医薬関係者の副作用報告」と「企業からの副作用等の報告」の期限のまとめと憶え方」などを参考に、憶えていってください。
んでは、本文に戻ります。
「医薬品の市販後においても、常にその品質、有効性及び安全性に関する情報を収集し、また、医薬関係者に必要な情報を提供することが、医薬品の適切な使用を確保する観点からも、企業責任として重要なことである。」
「製造販売業者等には、法の規定に基づき、その製造販売をし、又は承認を受けた医薬品について、その副作用等によるものと疑われる健康被害の発生、その使用によるものと疑われる感染症の発生等を知ったときは、その旨を定められた期限までに厚生労働大臣に報告することが義務づけられている。」
「なお、実務上は、法の規定により、報告書を総合機構に提出することとされている。」
ひとくちコメント
ざっくり言えば、医薬品の製造販売業者にも、副作用の報告が“法的”に義務付けられている、ってな次第です。
んで、報告先は、医薬関係者同様に、「厚生労働大臣」ですが、実務上は、「総合機構」です。
んでは、本文に戻ります。
「なお、薬局開設者、医療施設の開設者、医薬品の販売業者又は医師、歯科医師、薬剤師その他の医薬関係者(登録販売者を含む。)においては、法により、製造販売業者等が行う情報収集に協力するよう努めなければならないこととされている。」
「本制度は、1979年の薬事法改正により制度化され、製造販売業者等に対して国への報告を求めてきたが、その後1996年の薬事法改正により、製造販売業者等が副作用等の情報収集の義務を負うことが明記されている。」
「1979年に創設された副作用・感染症報告制度において、医薬品等との関連が否定できない感染症に関する症例情報の報告や研究論文等について、製造販売業者等に対して国への報告義務を課しているが、」
「それに加えて2003年7月からは、その前年に行われた薬事法改正により、血液製剤等の生物由来製品を製造販売する企業に対して、当該製品又は当該製品の原料又は材料による感染症に関する最新の論文や知見に基づき、当該企業が製造販売する生物由来製品の安全性について評価し、その成果を定期的に国へ報告する制度を導入している。」
「一般用医薬品に関しても、承認後の調査が製造販売業者等に求められており、副作用等の発現状況等の収集・評価を通じて、承認後の安全対策につなげている。」
ひとくちコメント
ざっくり言えば、医薬関係者には、製造販売業者の行う情報収集に協力する努力義務が課せられてます。
また、医薬品のみならず、生物由来製品にも、報告制度が設けられている、ってな次第です。
突っ込んだ出題はそうないので、いつもどおり、丁寧に読んで内容を把握しておけば十分かと思います。
んでは、本文に戻ります。
「具体的には既存の医薬品と明らかに異なる有効成分が配合されたものについては、10年を超えない範囲で厚生労働大臣が承認時に定める一定期間(概ね8年)、承認後の使用成績等を製造販売業者等が集積し、厚生労働省へ提出する制度(再審査制度)が適用される。」
「また、医療用医薬品で使用されていた有効成分を一般用医薬品で初めて配合したものについては、承認条件として承認後の一定期間(概ね3年)、安全性に関する調査及び調査結果の報告が求められている。
「要指導医薬品は、上記と同様に調査結果の報告が求められている。」
ひとくちコメント
登録販売者と直に関係ないし、こんな数字はさすがに出ないだろうと思っていたら、近年になって、出題されるようになりました。
数字は、ホント、なんでも出ます。
・既存の医薬品と明らかに異なる有効成分が配合・・・概ね8年:再審査制度
・医療用医薬品で使用されていた有効成分を一般用医薬品で初めて配合・・・概ね3年:調査及び調査結果の報告
…の、8年・3年は、押えておきましょう。
また、上述の規定は、要指導医薬品にも適用されているので、押えておきましょう。要は先の8年3年の数字が出るってな次第です。
いったん終わります。
ページリンク
「Ⅱ 医薬品の安全対策」の医薬品の副作用情報等の収集、評価及び措置 その2は、以上です。
「医薬品の副作用情報等の収集、評価及び措置 その3」に続きます。
補足リンク
大元インデックス・・・「Webテキスト インデックス」
本章インデックス・・・「適正使用 インデックス」
本節インデックス・・・「医薬品の安全対策 インデックス」
こまごましたもの
登録販売者の独学方法については、「登録販売者の独学」を、参考にしてください。
登録販売者のブログ記事などは、「サイトマップ」に、挙げています。
★みんなとシェアする
第2節 安全対策
通読用
サイト内リンク
登録販売者
概要
独学シリーズ
対策シリーズ
勉強方法
過去問+解説
├チェック問題 過去問リスト
├漢方 過去問リスト
├生薬 過去問リスト
├全ブロック 試験問題 科目別
├「医薬品的な問題」過去問リスト
├「添付文書」過去問リスト
└「資料問題」過去問リスト