適正使用の「医薬関係者の副作用報告」と「企業からの副作用等の報告」の期限のまとめと憶え方‐登録販売者
まずは初めに結論を。一口で言うと。まとめ。要旨。
登録販売者の試験科目「適正使用」の副作用の報告の期限についてまとめたページ。副作用報告には、「医薬関係者」と「企業」の2つの論点があり、頻出は前者である。しかし、最近になって、後者の「企業からの副作用等の報告」も、問われるようになってきているので、期限等の数字を整理する。
| カテゴリー: 資格こもごも | Tags: 登録販売者, 登録販売者 まとめ, 登録販売者 憶え方, 登録販売者 適正使用
「副作用報告」の期限ですが、「医薬関係者」と「企業」の2系統があります。
最もよく出るのは、前者の「医薬関係者」です。
しかし、最近では、後者の「企業」の副作用報告の期限が見られるようになっています。
両者は、別物なので、整理して覚えて行きましょう。
医薬関係者の副作用報告の期限
「医薬関係者」の副作用報告の期限ですが、これは、「特に定められていない」となっています。
手引きには…、
「報告期限は特に定められていないが、」
「保健衛生上の危害の発生又は拡大防止の観点から、報告の必要性を認めた場合においては、適宜速やかに、郵送、ファクシミリ又は電子メールにより、(略)、報告書を総合機構に送付することとされている。」
…とあります。
つまり、副作用の報告を“しなくてはいけない”のですが、具体的な日数は、“決められていない”のです。
んなもんで、たとえば、「登録販売者は、副作用を知ったときは、15日以内に報告しなければならない。」といった選択肢は、「×」となります。
当該報告期限で、一番よく出るのは、「医薬関係者」の「特に定められていない」なので、シッカリ頭に入れておきましょう。
後は、適宜「速やかに」のところを、押えておけば十分です。
なお、言うまでもないですが、登録販売者も、「医薬関係者」に該当しています。
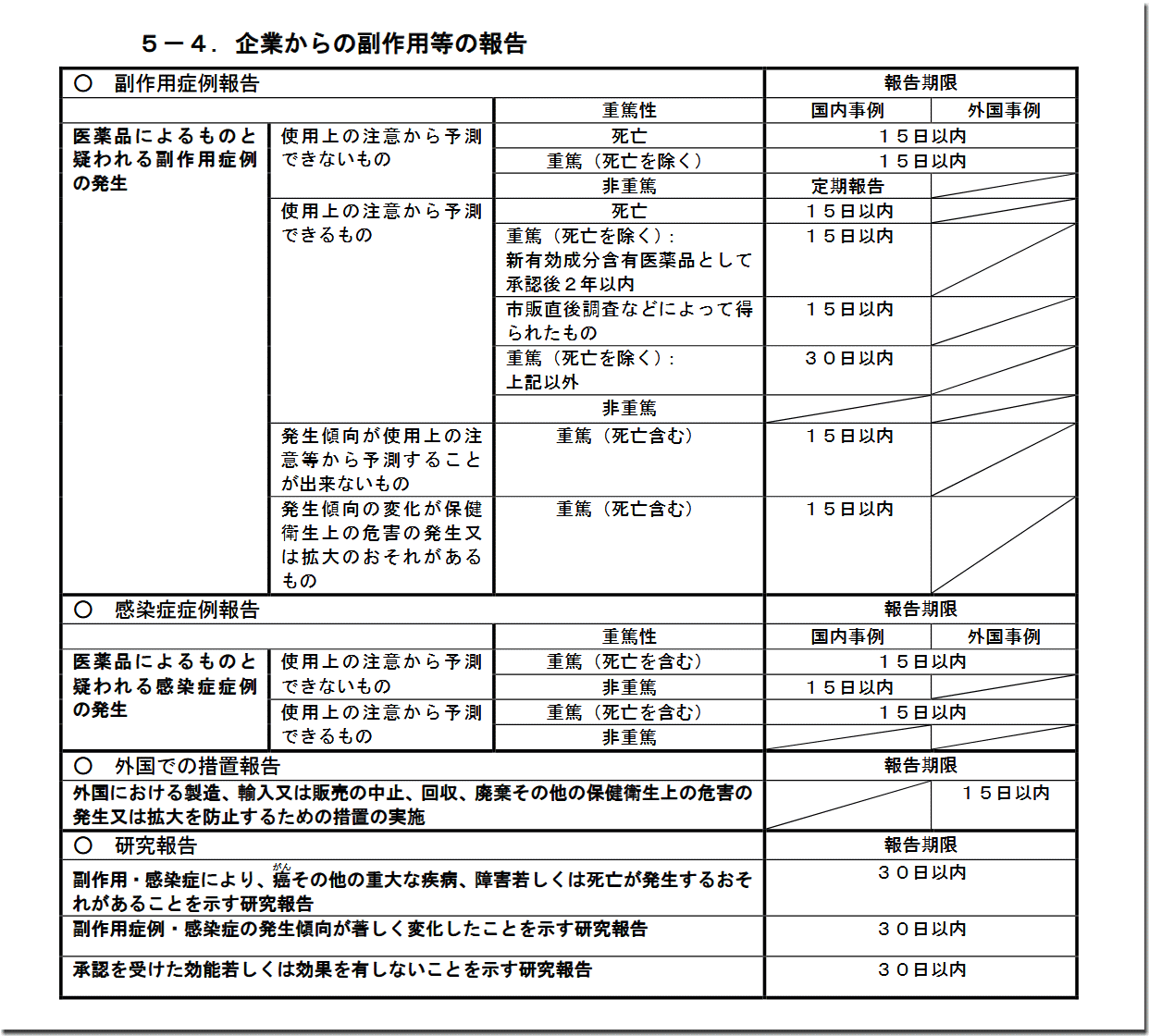
企業からの副作用等の報告
さて、これまでは、ほとんど出題実績がなかった「企業からの副作用等の報告」ですが、最近、頻繁に問われるようになっています。
下の画像が…、
…それです。
東京都試験では、「医薬品の製造販売業者が、その製造販売した医薬品について行う副作用の報告」という問題文で、連続して、問われています。
そのほか、福岡県でも、「R3 福岡 第58問」といった文章問題で、出題されています。
個人的には、「企業からの副作用等の報告」は、登録販売者と言うほど関係がないので、一過性のものと見ていました。
しかし、先に見たように、東京都では連続して出題されており、他の都道府県も追従して、「定番問題」化する可能性が高くなっています。(補足:関西広域連合では、「定番化」しました。)
んなもんで、相応の対策を、取っておくべき、といった寸法です。
まあでも、カンタンなので、下のようにざっくり押えてください。
対策1‐「外国事例」は、捨てる
まずもって、先の表を見ると、「国内事例」と「外国事例」の2系統あることがわかります。
結論から言うと、「外国事例」は、捨てます。
出題実績が「ない」うえに、「国内事例」の期限を押えるので、手一杯だからです。
今後、傾向が変わって、「外国事例」が問われるようになったら、押えるくらいでよいと思います。
(おそらく、外国事例が問われるにしても、他の選択肢にて、国内事例も同時に問われるでしょうから、当該国内事例の知識で、選択肢なり解答なりを絞ることができると思います。)
対策2‐定番の15日以内
さて、「企業からの副作用等の報告」ですが、まず…、
『大半の期限は、「15日以内」』
…と憶えます。
先の画像のように、ほとんどの期限(数字)は、「15日以内」となっています。
細かい規定がありますが、ぶっちゃけ、こんなのいちいち憶えてられません。
試験で問われた際は、最も多い「15日以内」と答えれば、当たる可能性も高いです。
よって、まずは、ざっくり、「15日以内」と憶える寸法です。
さて、数字の憶え方ですが、「企業からの副作用等の報告」をもじって、「企業副作用等報告」とします。
「企業副作用等報告」を、平仮名にすると、「きぎょうふくさようとうほうこく」です。
もうおわかりですね。
「き・ぎ・ょ・う・ふ・く・さ・よ・う・と・う・ほ・う・こ・く」で、ちょっきり「15文字」です。
んなもんで、「企業副作用等報告(きぎょうふくさようとうほうこく)が15文字なので、15日以内」と憶えます。
対策3‐定期報告
「15日以内」を憶えたら、次は、それ以外の期限を、押えます。
先の画像のように、15日以外は、「定期報告」が1つと、「30日以内」が2つしかありません。
んなもんで、これら3つを、個別的に憶えればいい、ってな次第です。
まず、「1つ」しかない「定期報告」から押えて行きましょう。
当該「定期報告」に該当するのは、「医薬品によるものと疑われる副作用症例の発生→使用上の注意から予測できないもの→非重篤」となっています。
文面を丸ごと覚える必要はないので、「医薬品の副作用・・・予測不可・・・非重篤→定期報告」くらいに、押えておけばいいでしょう。
対策4‐30日以内
んでは、残る「2つ」の「30日以内」を見ていきましょう。
まず、カンタンな方の「研究報告」を、憶えます。
そのまんまですが、「研究報告は、30日以内」くらいに、憶えるといいでしょう。
んで、もう1つの「30日以内」ですが…、
『医薬品によるものと疑われる副作用症例の発生→使用上の注意から予測できるもの→重篤(死亡を除く)』のケースで、「新有効成分含有医薬品として承認後2年以内」と「15日以内市販直後調査などによって得られたもの」以外の場合が「30日以内」
…となっています。
この規定は、もの凄くややこしいので、このページをお気に入りに入れておいて、通勤通学時に何回も見るか、それか、本試験の「適正使用」の直前の休み時間に押えるくらいでいいでしょう。
わたしなら、こんなヤヤコシイ規定は、すぐ忘れそうなので、ふだんの勉強で憶えようとは思いません。
「適正使用」の試験の直前にチェックするくらいです。
補足1・・・2年が出た!
「企業からの副作用等の報告」ですが、「医薬品によるものと疑われる副作用症例の発生」の「使用上の注意から予測できるもの」の「重篤(死亡を除く):新有効成分含有医薬品として承認後2年以内」の項目があるのは、先の画像で、見た通りです。
当該項目ですが、「承認後2年以内」のところが、「広島県 R3 午後56問」で、出題されています。
他県も、追随しそうです。念のため、押えておきましょう。
ホント、数字は、油断ができないですねー。
補足2・・・報告先
当該副作用の報告ですが、「医薬関係者」も「企業」も、報告先は、「厚生労働大臣」ですが、実務上は、「総合機構」となっています。
これもよく出るので、チェックしておきましょう。
ざっと、このあたりを押えておけば、「副作用報告」で失点は免れるはずです。
2019年12月17日 3:32 PM
★みんなとシェアする
 殺菌消毒成分等でウイルスに効くものの語呂合わせとまとめ‐エタノール,イソプロパノール,次亜塩素酸ナトリウム,サラシ粉,ポビドンヨード,ヨードチンキ
殺菌消毒成分等でウイルスに効くものの語呂合わせとまとめ‐エタノール,イソプロパノール,次亜塩素酸ナトリウム,サラシ粉,ポビドンヨード,ヨードチンキ
皮膚に用いる薬と公衆衛生用薬の「殺菌消毒成分」の定番論点に、「ウイルスに効くかど……続きを読む
まとめて読む
- 登録販売者の記事一覧
- 登録販売者 まとめの記事一覧
- 登録販売者 憶え方の記事一覧
- 登録販売者 適正使用の記事一覧